... está sendo produzida pelo Centro Nacional Gamaleya de Epidemiologia and Microbiologia (CNGEM), o qual se descreve como sendo a "instituição líder mundial em pesquisa", explicando que "O centro foi fundado em 1891 como um laboratório privado" e que "Desde 1949 carrega o nome de Nikolai Gamaleya, um russo pioneiro em estudos de microbiologia".
O Centro Gamaleya fala sobre a pesquisa da "Vacina contra COVID-19 / Informação geral / Atualmente, existem cerca de 165 vacinas diferentes para COVID-19 sendo desenvolvidas em todo o mundo. Os principais tipos de vacinas incluem vacinas vetoriais, inativadas, baseadas em ácido nucléico (DNA e mRNA) e vacinas baseadas em proteínas recombinantes. A vacina baseada em vetor de adenovírus russa foi registrada pelo Ministério da Saúde da Rússia em 11.Ago.2020 e se tornou a 1ª vacina COVID-19 registrada no mercado. O anúncio criou um chamado “momento Sputnik” para a comunidade global."
O site da Sputnik V está registrado em nome de Joint-Stock Company Management Company of the Russian Direct Investment Fund (Empresa de Administração da Empresa de Stocks-Conjuntos do Fundo de Investimento Direto da Rússia).
A Vacina Sputnik V não está sendo aprovada em qualquer país, mas apenas autorizado o uso emergencial, assim como aconteceu e acontece com as vacinas contra o Covid-19 da Moderna, da Pfizer e do Instituto Butantan. Nos seguintes comunicados de imprensa publicados pelo próprio CNGEM, lemos:
Honduras: "A vacina foi aprovada sob o procedimento de autorização para uso emergencial"
Egito: "Autoridade de Drogas do Egito aprovou a vacina sob o procedimento de autorização para uso emergencial"
Guyana: "A vacina foi aprovada sob o procedimento de autorização para uso emergencial"
México: "(...) aprovou a Sputnik V sob o procedimento de autorização para uso emergencial"
Ghana: "A vacina foi aprovada sob o procedimento de autorização para uso emergencial."
Equipe do Sputnik V
Denis Logunov : Doutor em Biologia, Membro Correspondente da Academia Russa de Ciências
Boris Naroditsky : Doutor em Biologia, Professor
Sergei Borisevich : Diretor, FGBU Central Research Institute No. 48 do Ministério da Defesa da Rússia, Doutor em Biologia, Candidato em Medicina, Professor
Andrei Botikov
Darya Grousova
Alina Dzharullayeva
Inna Dolzhikova : PhD
Darya Yegorova : PhD
Ilyas Yesmagambetov : PhD
Olga Zubkova : PhD
Tatyana Ozharovskaya
Olga Popova
Aleksandr Semikhin : PhD
Yelizaveta Tokarskaya : PhD
Amir Tukhvatulin : PhD
Dmitry Shcheblyakov : PhD
Dmitry Shcherbinin : PhD
Sobre os financiamentos ao desenvolvimento da vacina SputnikV, o Centro esclarece: "Trabalhando em conjunto com alguns dos principais investidores institucionais do mundo[quem são estes investidores?], selecionamos e financiamos o que acreditamos ser os sistemas de teste, medicamentos e vacinas COVID-19 mais promissores. O Fundo de Investimento Direto da Rússia (RDIF) apóia o desenvolvimento da vacina COVID-19 da Rússia pelo Centro Gamaleya e está investindo na produção em massa da vacina, por empresas do portfólio da RDIF".
O CNGEM esclarece que "O Sputnik V é a primeira vacina registrada do mundo baseada em uma bem estudada plataforma baseada em vetor adenoviral humano. (...) Os suprimentos de vacina para o mercado global serão produzidos pelos parceiros internacionais da RDIF na Índia, Brasil, China, Coreia do Sul e outros países."
Vacina de 2-vetores contra o coronavirus

Criação do vetor - Um vetor é vírus a que falta o gene
responsável pela reprodução e é usado para transportar para uma célula, material
genético de outro vírus contra o qual está sendo vacinada. O vetor não impõem
qualquer perigo ao corpo. A vacina é baseada em um vetor adenoviral que
normalmente causa infeções respiratórias virais agudas. / Um gene codificado
como Proteína S dos espinhos do SARS-COV-2 é inserida em cada vetor. Os
espinhos da “corôa” da qual o vírus obtém o nome. O vírus SARS-COV-2 usa espinhos
para entrar na célula. / Primeira vacinação : Vetor com gene codificando
Proteína S do coronavirus entra na célula / O corpo sintetiza Proteína S; em
resposta, a produção de imunidade, inicia. / Segunda vacinação : Vacinação
repetida acontece em 21 dias / A vacina baseada em outro vetor adenovírus desconhecido
ao corpo, impulsiona a resposta imune e providencia imunidade de longa duração.
/ O uso de 2 vetores é uma tecnologia única do Centro Gamaleya tornando a
vacina russa diferente de outras vacinas de adenovirus baseadas em vetores sendo
desenvolvidas globalmente.
Resposta imune primária : Primeira imunização - Imunização de impulso / Resposta imune secundária : Sputnik V - A primeira vacina Covid-19 registrada – Tecnologia comprovada de vetor adenovírus humano – impulso com outro vetor (Ad26+Ad5) / Outros 2 componentes vacina – impulso com o mesmo vetro (i.e.Ad26+Ad26) / 1 componente vacina – imunização singular única (i.e. Ad5)
No site do CNGEM, onde o Centro discursa sobre a segurança da sua vacina contra o Covid-19...
... com 9 ensaios, desde 2020, relacionados às pesquisas da vacina Covid-19:
237 NCT04341389 2020 508
241 NCT04437875 2020 38
242 NCT04442230 2020 96
243 NCT04436471 2020 38
244 NCT04313127 2020 108
245 NCT04398147 2020 696
248 NCT04505722 2020 60 000
249 NCT04509947 2020 125
250 NCT04436276 2020 1 045
Em todos os testes - e mais uma vez, idêntico ao que vimos nas vacinas da Moderna, Pfizer e Butantan - largos grupos de pessoas são deixadas de fora. Alguns exemplos:
▪ Pessoas com mais de 60 anos
▪ Grávidas
▪ Bebês amamentados por mães vacinadas
▪ Pessoas com alergias
▪ Cruzamento medicamentoso
▪ Pessoas que já pegaram Covid-19
Como exemplo, o ensaio NCT04437875 (18.Jun.2020), da CNGEM, publicado na Biblioteca Nacional de Medicina dos Estados Unidos como Um estudo aberto da segurança, tolerabilidade e imunogenecidade da Vacina "Gam-COVID-Vac Lyo" contra o COVID-19...
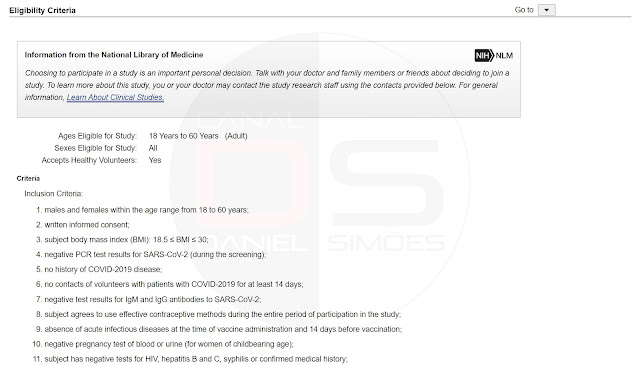
... para mostrar a lista de "critérios de inclusão" e "critérios de exclusão" de participação, como cobaia, das pesquisas da vacina:
Critério de inclusão:
▪ homens e mulheres na faixa etária de 18 a 60 anos;
▪ consentimento informado por escrito;
▪ índice de massa corporal (IMC) do indivíduo: 18,5 ≤ IMC ≤ 30;
▪ resultados negativos do teste de PCR para SARS-CoV-2 (durante a triagem);
▪ sem história de doença COVID-2019;
▪ nenhum contato de voluntários com pacientes com COVID-2019 por pelo menos 14 dias;
▪ resultados de teste negativos para anticorpos IgM e IgG para SARS-CoV-2;
▪ o sujeito concorda em usar métodos anticoncepcionais eficazes durante todo o período de participação no estudo;
▪ ausência de doenças infecciosas agudas no momento da administração da vacina e 14 dias antes da vacinação;
▪ teste de gravidez negativo de sangue, ou urina (para mulheres em idade fértil);
▪ o sujeito tem testes negativos para HIV, hepatite B e С, sífilis, ou história médica confirmada;
▪ o sujeito teve um resultado negativo no teste de urina para drogas narcóticas residuais;
▪ teste negativo para álcool no ar exalado;
▪ a ausência de doenças malignas de qualquer natureza e localização;
▪ na história médica e com base nos resultados da triagem, o sujeito não tem doenças, ou patologias, do sistema gastrointestinal, fígado, rins, sistema cardiovascular e sanguíneo, SNC, sistema musculoesquelético, sistemas urogenital, imunológico e endócrino que, do ponto de vista do pesquisador e/ou do organizador do estudo, pode afetar a segurança do voluntário e a avaliação dos resultados do estudo (os testes clínicos, instrumentais e laboratoriais não revelaram doenças ou desvios clinicamente significativos).
Critério de exclusão:
▪ envolvimento de voluntários em outro estudo nos últimos 90 dias;
▪ qualquer vacinação nos últimos 30 dias;
▪ história de doença COVID-2019;
▪ resultados de teste de PCR positivos para SARS-CoV-2 (durante a triagem);
▪ resultados de teste positivos para anticorpos IgM e IgG para SARS-CoV-2;
▪ equipe de saúde em contato com pessoas com COVID-2019;
▪ sintomas respiratórios nos últimos 14 dias;
▪ a administração de imunoglobulinas, ou outros hemoderivados nos últimos 3 meses;
▪ uso regular atual, ou passado, de entorpecentes;
▪ o sujeito recebeu agentes imunossupressores e/ou imunomoduladores 6 meses antes do início do estudo;
gravidez ou amamentação;
▪ exacerbação de doenças alérgicas no momento da vacinação;
▪ o sujeito tem pressão arterial sistólica menor que 100 mm Hg, ou maior que 139 mm Hg; pressão arterial diastólica menor que 60 mm Hg, ou maior que 90 mm Hg; freqüência cardíaca inferior a 60 batimentos por minuto, ou acima de 100 batimentos por minuto;
▪ uma história alérgica com carga (choque anafilático, edema de Quincke, eczema exsudativo polimórfico, atopia, história de doença do soro, hipersensibilidade ou reações alérgicas à introdução de quaisquer vacinas na história, reações alérgicas conhecidas aos componentes da vacina, etc.);
▪ uma história de doenças auto-imunes na história médica do voluntário e na história médica de parentes de 1 a 2 graus de parentesco;
▪ o sujeito fuma mais de 10 cigarros por dia;
▪ ingestão de álcool excedendo o nível de baixo risco: não mais do que 20 gramas de álcool puro por dia, não mais do que 5 dias por semana, ingestão de álcool nas 48 horas anteriores à administração da droga;
▪ hospitalização planejada e/ou cirurgia durante o período de participação no estudo, bem como 4 semanas antes da data prevista para a administração do medicamento;
▪ a presença de doença associada que pode afetar a avaliação dos resultados do estudo;
▪ quaisquer condições que, segundo o médico do pesquisador, possam ser uma contra-indicação para a participação no estudo.
No entanto, a segurança das vacinas está sendo garantida pelo CNGEM:
Segurança e Eficácia
"Após o início da pandemia de COVID-19, pesquisadores russos extraíram um fragmento de material genético do novo coronavírus SARS-COV-2 [isolaram o virus?], que codifica informações sobre a estrutura do pico da proteína S, que forma a “coroa” do vírus e é responsável para conexão com células humanas. Os pesquisadores o inseriram em um vetor de adenovírus familiar para distribuição em uma célula humana, criando a 1ª vacina COVID-19 do mundo. A fim de garantir imunidade duradoura, cientistas russos tiveram uma ideia inovadora de usar 2 tipos diferentes de vetores de adenovírus (rAd26 e rAd5) para a 1ª e a 2ª vacinação, aumentando o efeito da vacina. O uso de adenovírus humanos como vetores é seguro porque esses vírus, que causam o resfriado comum, não são novos e já existem há milhares de anos. A eficácia do Sputnik V contra COVID-19 foi relatada em 91,6%. O valor é baseado na análise de dados de 19.866 voluntários, que receberam a 1ª e a 2ª doses da vacina Sputnik V, ou placebo, no ponto de controle final de 78 casos COVID-19 confirmados. A eficácia do Sputnik V foi validada por dados internacionalmente revisados por pares publicados no
The Lancet."

Porém, no documento publicado (20.Fev.2021) no The Lancet, Segurança e eficácia de uma vacina de COVID-19 heteróloga com base em vetores rAd26 e rAd5: uma análise provisória de um ensaio clínico controlado randomizado de fase 3, na Rússia...
... o discurso do CNGEM é mais prudente:
“(...) nem todos os grupos de risco estão representados. Há uma necessidade de investigar mais a vacina em adolescentes e crianças em Planos de Investigação Pediátrica, bem como em mulheres grávidas e lactantes. A maioria dos participantes em nosso estudo eram brancos, por isso acolhemos investigação adicional em uma coorte mais diversificada. " (Pg680, Vol 397 February 20, 2021).
Também achei interessante quando dizem que "Durante o ensaio, além da visita de triagem e do dia da 2ª dose, nenhum teste de PCR adicional foi feito, exceto quando os sintomas de COVID-19 foram relatados pelos participantes." (pg 673, Vol 397 February 20, 2021).
Mas... dentro da narrativa alopática quanto à questão, não deveriam continuar a fazer testes PCR às pessoas que receberam a 2ª dose da vacina-teste de forma a verificar o tempo médio de eficácia da vacina?
Se tivessem continuado a fazer testes PCRs nas pessoas que receberam a 2ª dose da vacina-teste - e que agora está sendo vendida e aplicada em mais de 30 países - que média estaria, agora, quanto ao tempo de eficácia da vacina?
No ensaio Segurança, tolerabilidade e imunogenicidade de uma vacina COVID-19 vetorizada de adenovírus recombinante tipo-5 : um teste de escalonamento de dose, aberto, não randomizado, 1° em humanos, publicado (13.Jun.2020) pela CNGEM na The Lancet, lemos:
"A interpretação dos resultados deste estudo é limitada pelo pequeno tamanho da grupo, a curta duração do acompanhamento e a ausência de um grupo de controle randomizado. Como foi o 1° estudo em humanos da vacina COVID-19 vetorizada por Ad5, não foi projetado para medir a eficácia da vacina."
Até que ponto estamos fazendo escolhas conscientes?
Em artigo posterior, publicaremos mais dados sobre o Centro Nacional Gamaleya de Epidemiologia and Microbiologia (CNGEM).